电化学检测复杂生物液中(如血液,组织液)的疾病标志物已广泛用于疾病的早期诊断、预防和治疗。但是生物液中蛋白质在电极表面的非特异性吸附极大降低了电化学传感器电流响应,而且蛋白质的吸附会引发植入电极的免疫反应,进而诱导机体产生炎症反应。虽然利用聚乙二醇(PEG)修饰传感界面可降低蛋白质吸附对检测结果的影响,但是,当暴露于含有自由基的生理环境时,PEG易于被活性氧(ROS)分解导致电化学性能的降低。目前能够保持优良的电化学性能和高的耐受自由基攻击性能的电化学生物相容性界面设计仍具有很大的挑战。
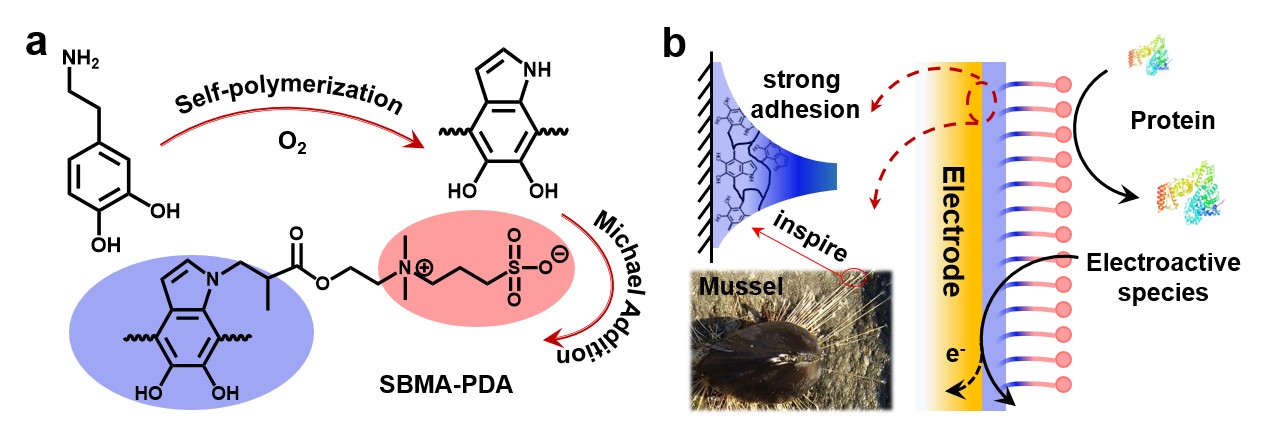
图1两性离子聚多巴胺膜修饰电极表面抗蛋白吸附示意图。
最近,中国人民大学化学系张美宁教授团队受贻贝粘附蛋白启发,使用聚多巴胺(PDA)作为电极功能黏附层,该层不仅可以将两性离子磺基甜菜碱甲基丙烯酸酯(SBMA)通过迈克尔加成反应接枝在电极表面防止蛋白质的吸附,而且聚多巴胺的邻位羟基能够消灭自由基从而防止了膜在体内的降解。所设计的SBMA-PDA膜在抗蛋白质吸附的同时,通过控制膜的厚度保持了良好的电子转移和物质传输的性质。
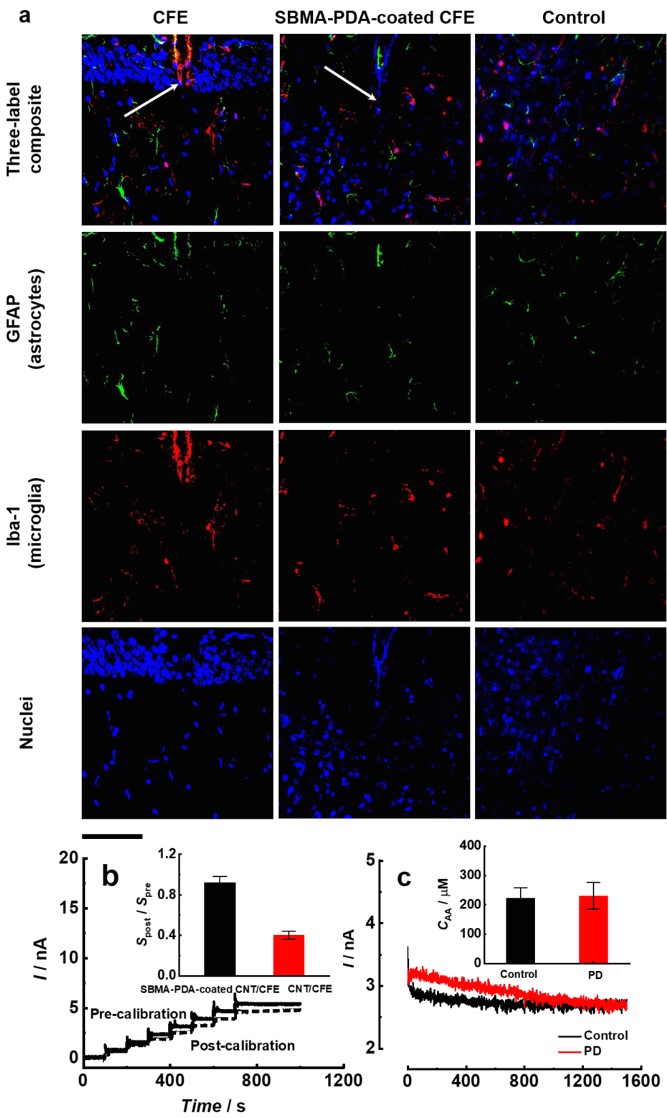
图2 SBMA-PDA的膜的生物相容性和活体原位电化学分析。
研究结果表明,当将SBMA-PDA膜修饰的微电极植入脑组织时,大大减小了植入电极对局部急性神经炎症反应的激活。经过SBMA-PDA膜修饰的碳纳米管微电极仍然保持了对脑内抗坏血酸的选择性和灵敏度,实现了活体内原位检测的前校准,并在正常和病理模型如帕金森症中保持了良好的稳定性。该研究有效解决了复杂生物样品中电化学检测中蛋白质吸附的问题,而且聚多巴胺膜可在任何基地上黏附,因此这种SBMA-PDA膜为生物复杂样品的分析检测提供了一种普适性的抗蛋白质吸附的界面设计新思路,对复杂生物样品分析,尤其是活体原位分析目标物提供了新的策略。
相关工作以“Zwitterionic-grafted Polydopamine Biointerface for In Vivo Sensing with high biocompatibility”为题发表于Angew. Chem. Int. Ed. 论文的第一作者是中国人民大学的冯涛涛博士,通讯作者是中国人民大学的张美宁教授。该项研究工作得到了国家自然科学基金委,中国人民大学大力支持。论文链接https://www.onlinelibrary.wiley.com/doi/epdf/10.1002/anie.202010675。